 Nel diabete e nell'invecchiamento, la glicazione delle proteine è un fenomeno di natura non enzimatica e quindi non facilmente controllabile.
Nel diabete e nell'invecchiamento, la glicazione delle proteine è un fenomeno di natura non enzimatica e quindi non facilmente controllabile.
La glicazione del collagene distorce la sua struttura, rende la matrice extracellulare rigida e fragile e allo stesso tempo abbassa la suscettibilità alla degradazione impedendone così il rinnovamento.
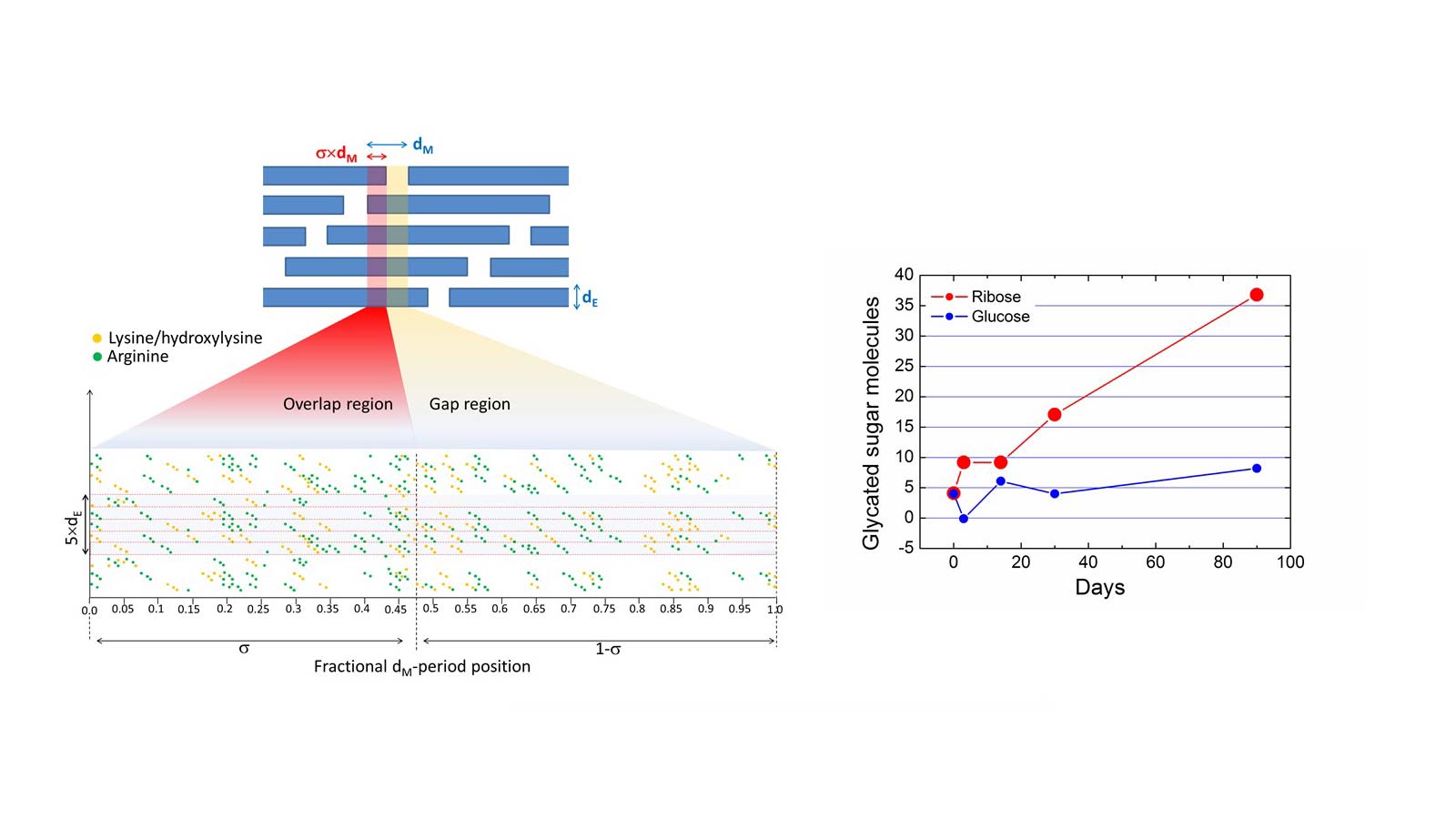
In questo lavoro, dati SAXS/WAXS hanno permesso di descrivere la glicazione del collagene di tipo 1 in biotessuti derivati da pericardio bovino, mantenuti in incubazione con eccesso di glucosio e ribosio da 3 a 90 giorni. I dati hanno mostrato che l'eccesso di glucosio determina una incorporazione di molecole 4-5 volte inferiore rispetto allo stesso eccesso di ribosio, con una rate (nel tempo) 38 volte più lenta.
Dal cambiamento di volume è stato elaborato un modello della glicazione in funzione del tempo, conseguente alla incorporazione degli zuccheri. Sono stati individuati gli amminoacidi arginina e lisina/idrossilisina del collagene come siti primari della glicazione.
Dott. Liberato De Caro - liberato.decaro(at)ic.cnr.it
Dott.ssa Cinzia Giannini - cinzia.giannini(at)ic.cnr.it
(IUCr) Time scale of glycation in collagen of bovine pericardium-derived bio-tissues
PSI
https://www.psi.ch/en/lsb
https://www.psi.ch/de/science
https://www.psi.ch/de/sls
https://www.psi.ch/de/psd

 Scienze chimiche e tecnologie dei materiali per i Beni Culturali
Scienze chimiche e tecnologie dei materiali per i Beni Culturali