 Modeling of LecB-Psl interactions favors binding to the side chain of Pslpatogenicità microbica e antibiotico-resistenza: scoperto uno dei sistemi di difesa del patogeno Pseudomonas aeruginosa
Modeling of LecB-Psl interactions favors binding to the side chain of Pslpatogenicità microbica e antibiotico-resistenza: scoperto uno dei sistemi di difesa del patogeno Pseudomonas aeruginosa
La resistenza agli antibiotici attualmente è divenuta una vera e propria priorità/emergenza di sanità pubblica a livello mondiale, non soltanto per le importanti implicazioni cliniche (aumento della morbilità, letalità, durata della malattia, possibilità di sviluppo di complicanze, possibilità di epidemie) ma anche per la ricaduta economica. Le infezioni da batteri antibiotico-resistenti, infatti, danno luogo a costi aggiuntivi per i farmaci, per le procedure, per l’allungamento delle degenze in ospedale e per eventuali invalidità.
Il 7 novembre 2018 l'Organizzazione per la Cooperazione e lo Sviluppo Economico (OCSE) ha pubblicato i risultati di uno studio – “Stemming the Superbug Tide – Just a few dollars more” dal quale emerge che il Sud Europa sarà una delle aree a maggiore rischio "tsunami" di super batteri. Tali Paesi presenteranno un maggiore incremento della mortalità dovuta ad infezioni da microorganismi resistenti agli antibiotici rispetto agli altri Paesi europei. In Italia, in media, circa 11.000 persone muoiono ogni anno a causa di un’infezione da uno degli 8 batteri antibiotico-resistenti, tra i quali Pseudomonas aeruginosa PAO1 (P. aeruginosa). Si stima che entro il 2050 un totale di circa 450.000 persone morirà a causa dell’antibiotico-resistenza. Secondo le proiezioni, si stima che l’antibiotico-resistenza costerà all’Italia circa 13 miliardi di Euro da qui al 2050.
P. aeruginosa è un batterio Gram-negativo, un patogeno opportunista nell’uomo che colpisce soprattutto persone con difese immunitarie o barriere fisiche (pelle o mucose) compromesse: è una tipica infezione nosocomiale Si tratta di uno dei microbi coinvolti dal fenomeno della Multi-Drug Resistance a più antibiotici e colpisce i pazienti con sistema immunitario “depresso”, i malati di fibrosi cistica a causa delle loro ricorrenti infezioni polmonari, etc. Questi batteri possono infettare sangue, pelle, ossa, orecchie, occhi, tratto urinario, valvole cardiache e polmoni, oltre alle ferite (come ustioni, lesioni o ferite da intervento chirurgico). L’utilizzo di dispositivi medici, come i cateteri inseriti in vescica o in vena, cannule per intubazione e ventilatori meccanici, aumenta il rischio di infezioni da P. aeruginosa. In ospedale i batteri sono spesso presenti nei lavandini, nelle soluzioni antisettiche e nei contenitori utilizzati per raccogliere l’urina da un catetere vescicale. Le manifestazioni cliniche che più comunemente si riscontrano sono l’aumento dei leucociti, la febbre, la disidratazione, ascessi, etc.
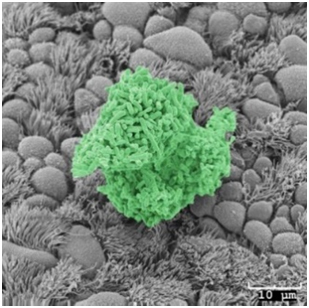 Gli organismi unicellulari solitamente mostrano due distinti stili di vita sociale. La prima è la familiare forma fluttuante, detta anche planctonica, nella quale le cellule isolate fluttuano o nuotano indipendentemente in un supporto liquido. La seconda è lo stato associativo aggregato, o sessile, in cui le cellule sono strettamente vincolate e fermamente attaccate l'una all'altra. Questa aggregazione, che dà luogo ad una sorta di pellicola – biofilm - è indotta dal contatto con una superficie di appoggio.
Gli organismi unicellulari solitamente mostrano due distinti stili di vita sociale. La prima è la familiare forma fluttuante, detta anche planctonica, nella quale le cellule isolate fluttuano o nuotano indipendentemente in un supporto liquido. La seconda è lo stato associativo aggregato, o sessile, in cui le cellule sono strettamente vincolate e fermamente attaccate l'una all'altra. Questa aggregazione, che dà luogo ad una sorta di pellicola – biofilm - è indotta dal contatto con una superficie di appoggio.
La maturazione del biofilm è regolata da un processo denominato quorum-sensing, un meccanismo in cui si mette in atto una modifica dell'espressione dei geni batterici in risposta all’aumento della densità di popolazione batterica.
Ciò che si viene a formare è quindi una struttura stratificata di batteri, ancorati gli uni agli altri per mezzo dei pili, in mezzo ai quali viene secreta la matrice polisaccaridica, all’interno della quale si formano dei canali d’acqua la cui funzione è quella di permettere la diffusione dei nutrienti.
I biofilm, la cui formazione è un processo influenzato da fattori ambientali (osmolarità, pH, O2, Ferro, nutrienti etc.), sono strutturati per consentire la respirazione e lo scambio di liquidi e sostanze nutritive, mentre impediscono l’accesso alle sostanze tossiche. Costituiscono perciò una barriera di difesa contro l’attacco degli antibiotici.
La matrice polisaccaridica, dove i batteri sono strutturati e coordinati in comunità funzionali capaci, se necessario, di cooperare nei processi metabolico-riproduttivi e infettivi, è principalmente composta da esopolisaccaridi neutri quali Pel e Psl, da DNA e RNA extracellulare e da vescicole lipidiche e proteine, che svolgono funzioni protettive nei confronti di fattori ambientali a loro sfavorevoli.
Il team di ricercatori dei Dipartimenti di Microbiologia dell’Università di Washington e dell’Università dell’Ohio coordinati dal Prof. M.R. Parsek e prof. D.J. Wozniak in collaborazione con il dott. D. Lamba dell’Istituto di Cristallografia del CNR di Trieste hanno per la prima volta svelato il ruolo funzionale e strutturale della proteina LecB. È stata validata la specificità dell’interazione tra la proteina con proprietà “adesive”, denominata lectina (dal latino lectum, legére: “aderire”) LecB e l’esopolisaccaride Psl, la cui unità ripetitiva è rappresentata da un pentasaccaride ramificato e contenente unità di carboidrati quali D-Mannosio, D-Glucosio e L-Rhamnosio.
-3)-β-D-Glcp-(1-3)-β-D-Manp-(1-3)-b-D-Manp-(1-3)-α-L-Rhap-(1-
2
│
1
α-D-Manp
Il complesso LecB-Psl contribuisce alla formazione ed all’organizzazione strutturale dei biofilms del patogeno P. aeruginosa. Inoltre LecB-Psl media l’adesione di P. aeruginosa alle cellule dei tessuti targets, concorrendo al persistere delle infezioni croniche ed alla resistenza del batterio alla terapia antibiotica tradizionale.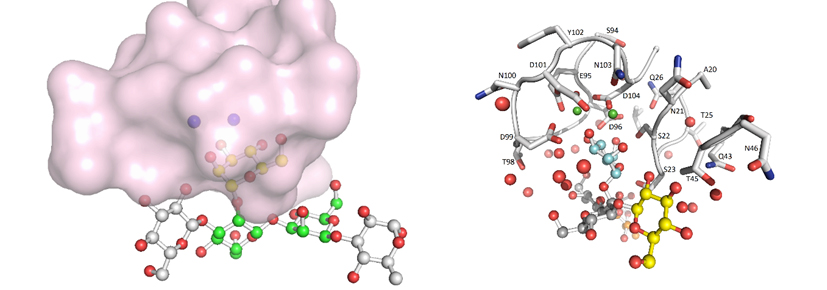
Questa scoperta ha anche delle rilevanti implicazioni per sistemi batterici multi-specie. Infatti è plausibile ipotizzare che P. aeruginosa possa utilizzare la lectina LecB, presente sulla membrana della superficie cellulare, per poter aderire ad esopolisaccaridi batterici planctonici o a proteine glicosilate (contenenti mannosio) presenti in biofilms di altre specie. La produzione di LecB permetterebbe inoltre a P. aeruginosa di fagocitare esopolisaccaridi prodotti dall’organismo ospite, quale meccanismo di camouflage dal sistema immunitario.
Questo studio potrebbe aprire la strada al disegno ed allo sviluppo di specifiche molecole, dette “glicomimetici”, con potenziale impiego terapeutico nelle infezioni croniche, mirate all’inibizione selettiva dell’interazione tra la lectina LecB e l’eso-polisaccaride Psl con la conseguente disgregazione del biofilm.
Riferimenti:
Passos da Silva D, Matwichuk M, Townsend D, Reichhardt C, Lamba D, Wozniak D, Parsek M
The Pseudomonas aeruginosa lectin LecB binds to the exopolysaccharide Psl and stabilizes the biofilm matrix.
Nature Communications 10, article Number: 2183 (2019); doi: 10.1038/s41467-019-10201-4
 Per informazioni:
Per informazioni:
Doriano Lamba
CNR - Dipartimento di Scienze Chimiche e Tecnologie dei Materiali
Istituto di Cristallografia
Area Science Park – Basovizza
Edificio Q1 - Stanza 106
Strada Statale 14 - Km. 163.5
I-34149 Trieste - Italy
E-mail: Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
Tel.: ++39 040 375 7527
https://www.nature.com/articles/s41467-019-10201-4

 Scienze chimiche e tecnologie dei materiali per i Beni Culturali
Scienze chimiche e tecnologie dei materiali per i Beni Culturali